萃取精馏是工业上广泛应用的一种特殊分离方法,主要用于分离普通精馏难以处理的含络合物、热敏物质、恒沸组成及相对挥发度接近1的互溶物系;其基本原理是向精馏塔中引入1种或2种可以与待分离混合物相溶的溶剂,破坏待分离组分间的相对挥发度,达到分离沸点相近组分的目的。萃取精馏从原理上可突破普通精馏汽液相平衡限制,已广泛应用于石油、精细化工、医药卫生等领域的基本有机化工品纯化分离和提浓。著名的青蒿素就是通过醚或汽油浸取后经超临界萃取蒸馏而实现提纯。
萃取精馏工艺一般是三元以上多组分的分离过程,所涉及基础热力学和过程分离动力学的理论比较复杂,目前研究和应用多集中在过程工艺模拟和实际生产领域。采用流程模拟软件Aspen Plus建立萃取平衡级数学模型,研究甲乙酮和N-甲酰吗啉混合萃取剂萃取精馏分离乙烯裂解C4馏分中烷烃和烯烃的工艺,获得了萃取精馏塔和溶剂回收塔的理论塔板数、进料位置、回流比、溶剂比等参数对分离性能的影响。采用萃取蒸馏由萃取剂回收脱硫分离出高纯度低硫的汽油添加剂甲基叔丁基醚(MTBE),实验优选了萃取剂、萃取剂用量、精馏温度和时间,克服了传统精馏工艺难以生产低硫含量MTBE的缺点。分析了兰州石化12 万t /a丁二烯萃取精馏装置开车周期短、塔压波动大、能耗高,产品质量不稳定的原因,并制定了相应的改造方案,降低了能耗,提高了产品合格率。
萃取精馏的过程工程设计和合理应用需要对该工艺技术的基本原理、工艺模型及操作参数调节等有深刻的了解。正确规范化的理解萃取精馏流程是其工业化应用的前提,对于新型精细化工品或药物的开发和提纯具有十分重要的意义。由于目前国内众多高等院校缺乏用于实验教学且能由学生自行组装和操作的萃取精馏实验装置,在“化工原理”等课程理论教学中,萃取精馏单元操作流程已成为一个比较抽象且难以理解的内容。本文结合热力学活度系数模型和化工过程工程的序贯模块法建立萃取精馏非平衡级模型,优化设计乙二醇萃取精馏分离乙醇-水共沸物系的工艺流程,由单一精馏塔流程同时实现乙醇萃取精馏分离和萃取剂回收两种工艺过程,通过设备参数设计和选型,组建了乙二醇萃取精馏分离乙醇-水恒沸物的实验室教学装置,结合“化工原理”类相关课程理论教学和实验操作,使学生充分理解萃取精馏原理、装置、工艺流程和操作规范。
1、实验装置设计
1.1 实验装置流程
实验装置流程如图1 所示。
1.2 汽液相平衡模型预测
汽液相平衡关系是萃取精馏模拟设计的基础,考虑物系中各组分均为极性化合物,选用预测精度较高的活度系数模型。本设计选择Wilson、NRTL和UNIQUAC模型预测乙醇-水二元体系汽液相平衡,三类模型预测结果与实验值均保持较好的一致;但对共沸温度和共沸点组成,Wilson模型预测误差较大,UNIQUAC模型结果与实验值相差小,这一预测结果与文献数据基本保持一致。另外,UNIQUAC预测发现乙二醇-水汽液相平衡线偏离y=x线很大,表明乙二醇萃取剂回收流程较为简易,实验中可通过萃取精馏塔流程改造来实现萃取剂回收操作。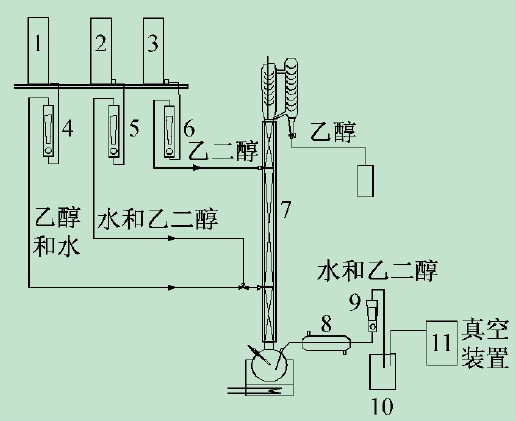
1,2,3-高位槽,4,5,6,9-转子流量计,7-三段式萃取精馏塔,8-冷却器,10-产品罐,11-真空装置
图1 乙二醇萃取精馏乙醇-水恒沸物系实验流程图
1.3 萃取精馏过程MESHRF工程模型
利用流程模拟设计开发分离工艺较经验方法有诸多优点,可充分利用动量、热量和质量传递的理论基础,结合必要的物性实验数据,数值模拟精馏塔内汽、液相流量、组成、温度分布关系等关键操作参数。本研究结合平衡级MESH 方程组和非平衡速率级RF方程组建立描述萃取精馏的过程工程模型,一般涉及6 类守恒关系式:
(1) 物料平衡M 方程。M 方程包含i 组分的总物料衡算式: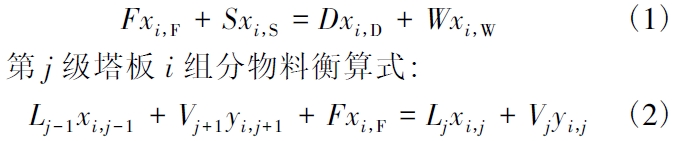
式中:F、S、D 和W 分别为进料量、萃取剂量、精馏塔顶采出量和塔底采出量,kg /h; Lj和Vj分别为第j 块塔板的液相和气相流量,kg /h;xi,j和为yi,j分别是第j 块塔板或j 类液相和气相中i 组分的质量分率;当j 为非进料级时,F=0。
(2) 相平衡E 方程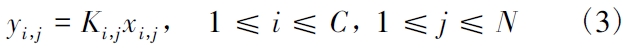
式中:Ki,j是i 组分在第j 块塔板的气液平衡常数;C 为总物料数;N 为总理论板数。
(3) 热量平衡H 方程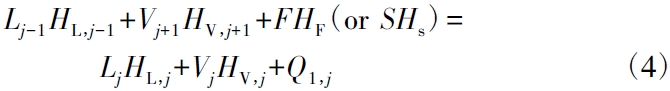
式中:Hi,j为i 在第j 级塔板上的焓值,kJ /kg;L 和V 分别为液相和气相;Ql,j是第j 级塔板热损失,kJ /h。
(4) 归一化S 方程。j 级平衡板汽液两相组成应满足: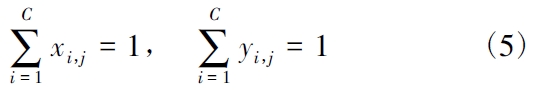
(5) 气、液相间非平衡级的传质、传热动力学R方程。
(6) 描述萃取塔内气、液两相非均匀混合和非理想流动性质F 方程式。
此模型采用Aspen Plus 软件RadFrac 模块Equilibrium 和Rate-based 速率级算法模拟设计,部分关键参数的模拟结果如表1 所示。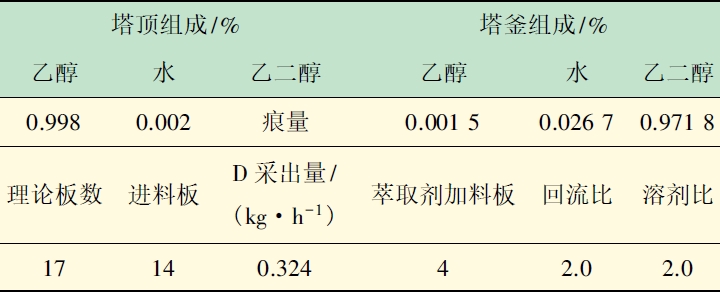
表1 萃取精馏塔优化设计部分模拟结果
2、实验步骤
2.1 实验准备
为便于实验室组装,选用金属θ 环填料,每米与20 块理论板相当。塔体分溶剂回收、精馏和提馏3段装配,内径均为29 mm 磨口玻璃柱,填料高为0.20、0.60 和0.30 m,此分段主要是考虑萃取塔作为溶剂回收塔时,精馏段与提馏段比与模型设计一致均为8 ∶3。具摇摆磁铁漏斗精馏头,三口烧瓶塔釜,200 mm 冷凝器,数显恒温加热套,电加热带,流量计,支架,高位槽,产品罐,离心泵和循环水真空泵。
2.2 实验装置测试
(1) 分析方法。将高精度阿贝折光仪与超级恒温水浴连接,调节温度为(20±0.1) ℃。
(2) 原料配备。将三口烧瓶置于恒温加热套中,并投入少许沸石;将1.0 L,95%乙醇-水溶液和1.0 L乙二醇分别置于高位槽。
(3) 萃取精馏装置组装。将Ф3 不锈钢θ 环填料填装于精馏塔柱,堆积密度320 kg /m2;串联3 段塔柱,并与三口烧瓶磨口连接,缠绕加热带,接通原料、萃取剂进料口与高位槽间的控制阀和流量计,塔顶装配精馏头和冷凝器,保持全塔密封良好。
(4) 全回流操作。塔顶冷凝器通冷凝水,将塔釜加热至溶液沸腾,接通加热带电源,缓慢升高电压至塔顶达稳定回流。开始计时,保持全回流操作30 min,使塔内形成稳定浓度梯度,每5 min 记录塔底和塔顶温度。
(5) 加萃取剂全回流操作。全回流稳定后,调节流量计,使乙二醇以2.0 mL /min 进料(由于萃取剂常温进料,加热带可稍升高电压),维持全回流操作并稳定30 min。
(6) 连续萃取精馏操作。待全回流稳定后,启动回流比控制器,控制回流比为2.0,塔顶开始出料,每5min 采集塔顶样品,并记录塔釜塔顶温度。用阿贝折光仪分析其组成,直至高位槽中乙醇-水恒沸溶液达到警戒液位,进料停止。
(7) 溶剂回收操作。当塔顶产品中水含量增加时,停止萃取剂进料,升高塔釜和保温带电压,增大回流比至3.0。由塔顶蒸出较纯水后,分析塔釜乙二醇组成,达标后停止加热,采出溶剂可循环使用。
3、实验结果与讨论
3.1 萃取精馏过程分析
通过萃取精馏实验操作,得到的数据见表2。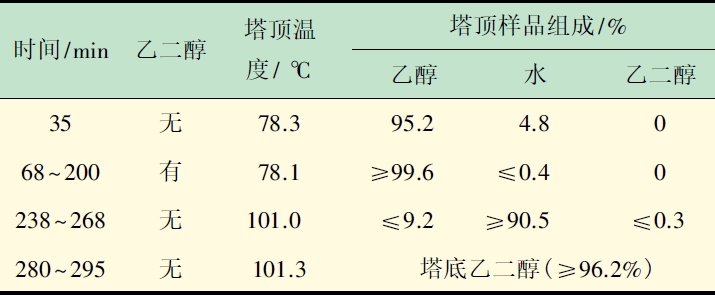
表2 萃取精馏分离乙醇水恒沸溶液实验检测结果
表2 萃取精馏分离乙醇水恒沸溶液实验检测结果由表2 可知,实验35 min 时,未加入萃取剂,全塔为全回流状态,塔顶产品组成与原料相似,为乙醇水的恒沸物,温度为恒沸点;加入乙二醇后,塔顶乙醇产品纯度明显提高,达到99.6%以上,塔顶温度变化较小,此时为纯乙醇沸点,说明萃取剂在精馏过程中起到了萃取精馏的作用。238 min 后,塔顶温度快速升高到101.0 ℃,原料液已达警戒液位,停止进料,塔顶产品分析表明乙醇已被*萃取精馏分离,塔顶存在大量水,此时停止萃取剂进料进入溶剂回收阶段。290 min后,塔顶分离物中乙二醇含量增加,停止精馏,塔底可获得96.2%乙二醇循环使用。
3.2 产品乙醇浓度测定
萃取精馏实验中,每5 min 采集塔顶产品分析其组成,实验结果列于表3。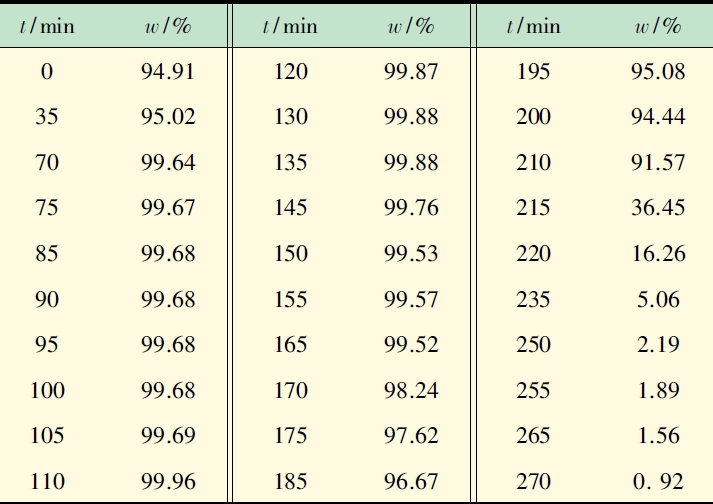
表3 乙醇水恒沸液萃取精馏过程中产品乙醇浓度由
表3 可看出,乙二醇加入后,立即破坏乙醇水恒沸点,塔顶乙醇由恒沸组成的95%迅速升至99.64%,110 min 时,乙醇纯度达到高99.96%。在70 ~ 165min 内,萃取精馏均能获得纯度高于99%乙醇产品。170 min 时进料停止,随后乙醇被*萃取分离,塔顶浓度急剧下降,水含量增加,至270 min 时乙醇含量仅0.92%。塔顶温度迅速升至水的沸点,萃取塔分离乙二醇-水溶液,达到萃取剂回收阶段。
3.3 萃取精馏塔温度曲线测定
图2 给出了塔釜和塔顶温度变化曲线,塔釜温度
比塔顶温度高,起始阶段釜温变化较平缓,为全回流稳定阶段(I);加入萃取剂后(II),温度平缓上升,直至乙醇被*萃取分离,此时塔釜温度约200 ℃;萃取剂回收阶段(III),塔釜温度保持恒定,这一变化规律有助于实验中通过调节塔釜加热量控制萃取精馏进程。另一方面,与表3 对比可知,塔顶温度变化严格对应着塔顶产品组成的改变,这一规律有助于实验中产品组成控制,第II 阶段为乙醇水恒沸液萃取精馏阶段,塔顶乙醇纯度均达99.9%。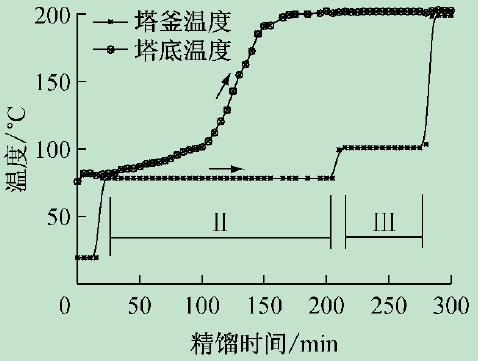
图2 萃取精馏塔釜和塔顶温度变化曲线
萃取精馏终了时,99%乙醇收率为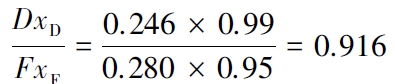
塔底96.2%乙二醇回收率为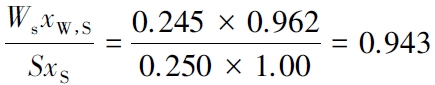
由以上实验表明,此装置实现了乙二醇萃取精馏分离乙醇-水恒沸物系。所用药剂无毒无害,可由学生独立依据过程工程基本理论完成设计并组装实验装置。
萃取精馏是石油化工和医药行业重要的基本分离单元,在化学工程理论教学中由于涉及较复杂的多元物系热力学和动量、热量及质量的“三传”分离动力学过程,其理论教学一直难以指导实际萃取精馏分离工程。本研究利用过程工程的序贯模块法优化设计了可辅助理论教学的萃取精馏实验室装置,通过热力学活性系数模型结合传质动力学MESHRF 模型模拟乙二醇萃取精馏分离乙醇-水恒沸物系,将萃取精馏与溶剂回收流程联合,简化工艺;采用θ 环填料搭建溶剂回收、精馏和提馏三段式连续萃取精馏装置,萃取分离出99%纯度乙醇,收率达91.6%,同时实现萃取剂回收,回收率达94.3%。本研究模型和实验装置均可由学生独立设计完成,装配简便,分离效率高,测量准确,易于操作和控制,在化工过程装备及化工原理理论教学将中发挥积极的作用。
电话
微信扫一扫
